近日,《德国应用化学》(Angewandte Chemie International Edition)发表了588888纽约国际官方网站邓子新院士团队孙宇辉教授课题组在聚酮合酶(Polyketide synthase, PKS)生物合成领域最新研究进展,揭示了PKS结构域可通过一种新颖而独特的跨模块“借用”方式实现聚酮链的双键还原。这也是该课题组继2017年继发表在《德国应用化学》相关工作的基础上,针对这一研究再次取得的最新突破。588888纽约国际官方网站博士生翟贵发和化学与分子科学学院博士生王文艳为该论文共同第一作者,孙宇辉教授为该论文通讯作者。该研究得到国家重点研发计划和微生物代谢国家重点实验室开放课题的支持。
聚酮化合物是自然界由细菌、真菌和植物通过连续的缩合反应产生的一类重要的天然产物,因其结构和生物活性的多样性,在医药、畜牧和农业领域已得到广泛地应用,成为维系人类健康和经济产业的重要支撑。PKS是完成这些种类繁多的聚酮化合物生物合成的核心催化机器,它在自然界漫长的进化历程中已经形成了一套普遍遵循的严密、精巧、高效的构造和流程,其中了解较为透彻的I型PKS通常是由一个至多个催化一轮碳链延伸的模块(Module)组成,每个模块又包含多个执行特定催化功能的结构域(Domain)。通常情况下,在聚酮碳链骨架的合成过程中,PKS模块和结构域的数量和功能与其所催化形成的相应化学结构之间存在着严格的线性对应关系,即聚酮链合成的底物选择、还原程度和产物的立体化学构型都是由PKS上相应模块中的结构域所决定,通过对酮基选择性地还原和脱水,从而在终产物的相应位置形成酮基、羟基、双键等功能团,同时还可决定产物手性中心的立体化学构型。这一上世纪九十年代初首先在红霉素PKS中的这一重大发现有其非同寻常的意义,它意味着聚酮化合物的结构具有极大的可塑性,可通过PKS模块或结构域的人工设计,重组出新的生物合成途径和符合人们预期的非天然“天然”产物,这也正是PKS吸引人们进行深入研究的魅力所在。
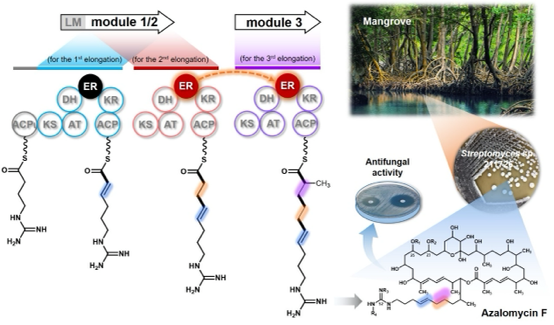
来自海南红树林的链霉菌Streptomyces sp. 211726所产生的阿扎霉素(Azalomycin F)正是自然界中众多聚酮天然产物的一员,这一大环内酯抗生素具有优良的抗真菌活性,特别是抗肿瘤活性的发现,更加激发了人们对其生物合成研究的浓厚兴趣。孙宇辉教授课题组在前期的探索中,发现在阿扎霉素貌似寻常的分子结构中掩藏着一个有悖于上述经典的结构与功能共线性规律的反常现象,并以此为契机,通过系统运用微生物分子遗传学及生物化学研究手段,首次挖掘出暗藏在PKS中一种可自动开关的烯醇还原酶结构域(Enoylreductase, ER),即在一个可重复使用的PKS模块中,同一个烯醇还原酶结构域可以根据需要在两次碳链延伸过程中,如电源开关般进行关闭或开启,从而催化形成不同的结构(Angew. Chem. Int. Ed. 2017, 56: 5503-5506)。尽管如此,但在相邻模块中与相应结构所对应的烯醇还原酶结构域的缺失依然是一个难解之谜。为了解答这一困扰,首先利用体内遗传学方法证明了Module 1/2中的ER1/2结构域参与了Module 3聚酮链中间体双键的还原过程。为进一步验证ER1/2结构域这一独特的催化现象,在体外重建了Module 3聚酮链的延伸及中间体双键的还原过程,最终证明了ER1/2结构域不仅具有选择性催化双键还原的特性,同时还具有以反式作用方式催化相邻模块Module 3上聚酮链中间体双键的还原。
此外,还对Module 1/2进行了结构域拆分及体外活性测试,更为精细地考察了Module 1/2中其它结构域在ER1/2结构域“借用”中的发挥的作用。通过对比分析不同组合ER1/2结构域的催化活性,证明了ER1/2与酮基还原酶结构域(Ketoreductase, KR)KR1/2是以反式作用催化Module 3聚酮链中间体双键还原的最小功能单元,该结果也暗示了KR1/2结构域对于ER1/2结构域发挥“借用”功能在空间结构上可能具有一定的辅助功能。尽管PKS功能与产物结构非线性对应的案例偶有发现,但相邻催化模块之间的这一新颖而独特的结构域跨模块“借用”方式依然让我们对自然界的鬼斧神工充满惊喜和期待。这一发现也让我们有机会一窥这个丰富多彩大自然的奥妙与神奇,不仅进一步拓展了人们对PKS经典的线性装配模式的认知,也进一步丰富了聚酮化合物组合生物合成的工具库,有望为聚酮药物的人工创新提供新的契机和灵感。
原文链接:https://onlinelibrary.wiley.com/doi/10.1002/anie.202011357