乳腺癌是女性最常见的恶性肿瘤之一。70%的乳腺癌是雌激素(Estrogen,E)依赖性肿瘤,雌激素通过与雌激素受体(Estrogen receptor, ER)作用促进乳腺癌细胞生长。乳腺癌细胞的转移是女性患者致死的主要原因之一,它之所以发生转移,除了癌细胞本身的因素外,还跟肿瘤组织周围的非可控性炎症反应有关。这些炎症反应会导致肿瘤组织的浸润和转移,同时能增加肿瘤的发生率及致死率。
近年来,关于NF-κB (Nuclear factor kappa B)参与炎症的发生过程被广泛研究,并发现NF-κB与ER这两类转录因子之间存在相互作用,在机体的多种生理病理过程包括乳腺癌中发挥重要的调节作用。因此,在分子水平上全面认识两种转录因子之间的相互作用,开展同时靶向ER和NF-κB双靶点药物研究,将为乳腺癌等疾病的激素替代治疗(Hormone replacement therapy, HRT)提供新方法和技术指导。
近期,588888纽约国际官方网站周海兵团队在选择性雌激素受体调节剂(Selective Estrogen Receptor Modulators, SEMRs)最新研究进展和前期工作基础上,利用基于结构的药物设计策略,将具有抗炎活性的白藜芦醇结构引入到具有特殊三维立体结构的氧桥双环庚烯类(OBHS)优势药效骨架中,将二者“有机”结合,构建了一系列新型SERMs分子。并从中进一步筛选发现最优化合物26a,其抗肿瘤和抗炎效力较母体化合物都有显著提高,并且在小鼠体内表现出积极作用,等剂量时,相较于他莫昔芬,化合物26a表现出了更好的抗肿瘤活性和他莫昔芬不具备的抗炎活性(图1)。
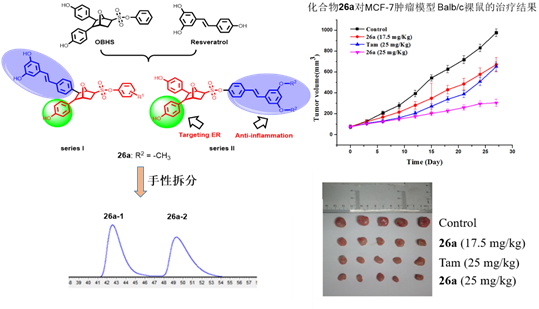
图1. OBHS-RES共轭物26a的设计、结构及其抗肿瘤效果。
在细胞水平中,观察到将NF-κB的核定位阻断剂JSH-23与化合物26a联用,处理48小时,显著降低了化合物26a对MCF-7细胞的增殖抑制活性。同时,通过对MCF-7肿瘤模型的Balb/c裸鼠体内肿瘤周围组织的免疫组化结果分析(图2),观察到化合物26a给药两周可以抑制炎症因子IL-6,TNF-α和NF-κB的表达,由此可以得出结论,化合物26a的抗炎活性可能有助于其抗肿瘤活性。
图2. 化合物26a在MCF-7乳腺癌模型Balb/c裸鼠的抗肿瘤进展期间表现出抗炎作用。治疗2周后肿瘤周围组织中的IL-6,TNF-α和NF-κB的免疫组织化学结果。比例尺,50 μm。柱状图中显示肿瘤周围组织中的IL-6,TNF-α和NF-κB的定量分析结果(n = 4)。
最后,作者对化合物26a进行了手性拆分,发现其中一种绝对构型化合物活性明显优于另一绝对构型化合物。从分子对接模型的结果可以看出,两个分子的苯磺酸酯部分是起到拮抗作用的关键,它们与半胱氨酸530形成的氢键对螺旋11起了强烈的挤压碰撞,造成了螺旋11的错位偏移,从而产生拮抗效果。而化合物26a-2与缬氨酸533所形成的氢键进一步增强了这种作用,此外,由于苯酚羟基与谷氨酸380形成的氢键起了稳定构象的作用,因此,化合物26a-2表现出更优越的活性(图3)。
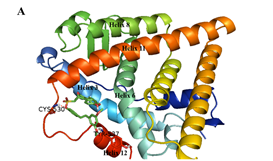
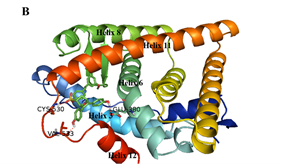
图3. 手性异构体26a-1和26a-2与ERα结合的对接分析结果(PDB: 3ERT)。
这一成果以增列封面文章发表在9月27日最新一期药物化学顶尖期刊Journal of Medicinal Chemistry上(2018, 61 (18), 8155-8173;文章链接:https://pubs.acs.org/doi/10.1021/acs.jmedchem.8b00224)。588888纽约国际官方网站周海兵教授是本论文通讯作者;588888纽约国际官方网站博士研究生宁文涛和胡志烨为该论文共同第一作者,588888纽约国际官方网站生命科学学院黄健教授等师生为共同作者。
周海兵研究团队多年来从事雌激素受体的细胞特异性分子机制和结构新颖、具有雌激素受体细胞特异信号调控功能的小分子及药物先导结构的设计和优化研究。基于药物化学与结构生物学分型平台,深入研究了多个系列结构新颖、活性好、选择性高以及功能特异的雌激素受体调节剂,进而阐明了多个ER新型药效结构生物学基础 (J. Med. Chem. 2012, 55, 2324; J. Med. Chem. 2013, 56, 3346; J. Med. Chem., 2014, 57, 3532)。同时,根据乳腺癌多重病因设计合成了靶向雌激素受体(ER)和组蛋白去乙酰化酶(HDAC) 的双靶点抗肿瘤候选药物,将具有特殊结构及特异活性的氧桥双环庚烯类(OBHS)骨架和HDAC 抑制剂SAHA侧链巧妙结合,得到了OBHS-SAHA共轭化合物,系统考察了这些新型双靶点共轭物的构效关系,得到一系列活性更高、更安全的先导化合物。细胞水平研究发现,数个化合物活性明显优于现有药物,为开发高效、低毒核受体靶向药物提供了新的思路(J. Med. Chem. 2015,58, 4550)。
此外,课题组亦十分注重利用分子影像技术促进新药发现。先后开发了具有高ERβ亲和力和亚型选择性的荧光探针,可以在细胞水平实现对ERβ特异选择性成像(Chem. Commun.2018, 54, 3887);以及高灵敏的具有荧光开/关功能的靶向ER探针,可用于选择性雌激素受体下调剂(Selective Estrogen Receptor Downregulators, SERDs)的筛选及机制研究(Sensor Actuat. B-Chem. 2018, 272, 589)。
以上研究工作得到国家自然科学基金、教育部科学技术研究重大项目、湖北省医学领军人才,以及病毒学国家重点实验室等的支持。
