近日,国际知名学术刊物《自然·通讯》(Nature Communications)在线发表了588888纽约国际官方网站邓子新院士团队陈文青教授课题组题为“Efficient biosynthesis of nucleoside cytokinin angustmycin A containing an unusual sugar system (含独特糖环单元的核苷类细胞分裂素狭霉素A的高效生物合成)”的重要研究成果。588888纽约国际官方网站为该论文的第一署名单位,研究生于乐、周文婷与佘一玄为共同第一作者,陈文青教授与美国农业研究服务中心的Neil P. J. Price博士为共同通讯作者。
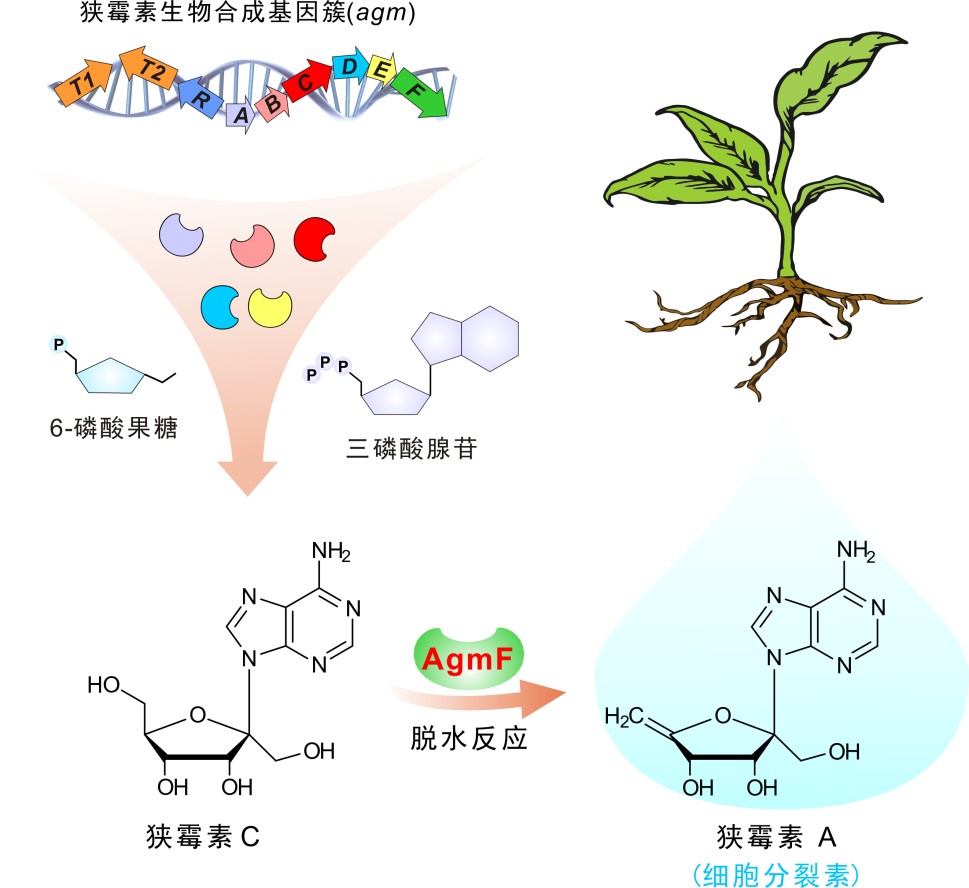
狭霉素A糖环单元上的双键结构非常罕见,暗示其生物合成中含有前所未有的酶促反应;更有趣的是,该结构的存在赋予了狭霉素A丰富的抗肿瘤、抗分枝杆菌以及细胞分裂素等生物活性。现有研究表明,狭霉素A作为一种新型绿色植物细胞分裂素,能有效诱导植物不定根芽的分化发育,令人惊喜的是,它对于三七、罗汉果、水稻及小麦等重要经济植物具有显著的增产促生长作用,因而显示出广阔的应有前景。长期以来,科学家们对狭霉素A的生物合成展现出浓厚的研究兴趣,然而其生物合成机理一直悬而未决。
陈文青课题组另辟蹊径,从狭霉素A的结构与活性特征出发,成功克隆到该抗生素的生物合成基因簇,并确定出9个基因(其中6个结构基因)负责其生物合成;与此同时,综合多学科研究手段,进一步破解了狭霉素A生物合成中最后一步脱水反应的酶促反应机理,揭示其通过一种令人惊叹的自给自足方式来实现辅因子循环。此外,该课题组利用合成生物学策略,在体外重构了狭霉素A的生物合成途径,并改造大肠杆菌为细胞工厂成功实现了其高效工程化产生。
此项成果是陈文青课题组继多氧霉素、喷司他丁及阿糖腺苷等生物合成研究取得系列突破后,在核苷类药物研究领域取得的又一项原创性、系统性研究成果,为深入揭示核苷类细胞分裂素的生物合成与产业化应用奠定了坚实的基础。据悉,该课题组已与国内相关知名企业在“核苷类药物生物智造”方面展开了全面战略合作,对夯实和提升我国相关微生物药物产业化的技术水平和产品的国际竞争力将起到重要的驱动与示范作用。588888纽约国际官方网站邓子新院士团队长期致力于重要微生物药物的代谢工程和合成生物学研究,近年来,该团队在微生物药物生物合成及合成生物学研究领域获得多项具有显示度的标志性研究成果,并已成为该领域具有国际影响力的生力军。
论文链接:https://www.nature.com/articles/s41467-021-26928-y