近日,《美国科学院院报》(Proceedings of the National Academy of Sciences of the United States of America,PNAS)在线发表588888纽约国际官方网站、中南医院药学研究院教授王隆飞课题组关于人源V-ATPase和mTOR的研究成果。
论文题为“Identification of mEAK-7 as a human V-ATPase regulator via cryo-EM data mining”(《发现mEAK-7是一个V-ATPase的调控因子》)。588888纽约国际官方网站中南医院和588888纽约国际官方网站为第一单位,王隆飞为第一作者兼共同通讯作者,美国俄亥俄州立大学教授傅天民为共同通讯作者,英国牛津大学博士吴迪和教授CarolRobinson为本研究提供了重要支持。
已有研究表明,V-ATPases介导了许多重要的信号转导过程,包括Wnt、mTOR和Notch等,许多起调节作用的蛋白质可直接与V-ATPases结合,通过调节V-ATPases的活性和定位完成信号转导,然而具体的作用机制还未见报道。V-ATPases是大型的膜蛋白复合物,主要功能是作为质子泵维持溶酶体pH。V-ATPase整体结构呈哑铃形,包含一个称之为V1的胞内复合物和一个被称为Vo的跨膜复合物。V1通过水解ATP驱动Vo转动,进而把质子从Vo的细胞质区域转移到Vo溶酶体内侧,实现了质子逆浓度梯度转移的过程。V-ATPases不仅是溶酶体上的质子泵,而且还是多种细胞内信号转导的枢纽。
为了鉴定V-ATPase结合伙伴,作者基于从HEK293细胞中纯化的人V-ATPase的大型冷冻电子显微镜数据集,行了多轮分类和重点细化。通过结构分析、人工智能建模和质谱验证,作者发现mEAK-7与状态2下的V-ATPase中的V1复合体紧密结合。进一步分析表明,mEAK-7与状态2中的V-ATPases的亚基A、B、D和E相互作用。由于mEAK-7参与了哺乳动物mTOR信号转导,作者提出mTOR和V-ATPase的功能具有紧密联系,并且mEAK-7可能通过结合状态2下的V-ATPases来调节V-ATPase功能,并介导mTOR信号转导。
该研究为未来研究mEAK-7在mTOR信号转导和V-ATPase调控中的作用奠定了基础。由于V-ATPase和mTOR在细胞防御、炎症和癌症等疾病中扮演的重要的角色,该研究也为未来的相关疾病的药物研发提供了分子基础。
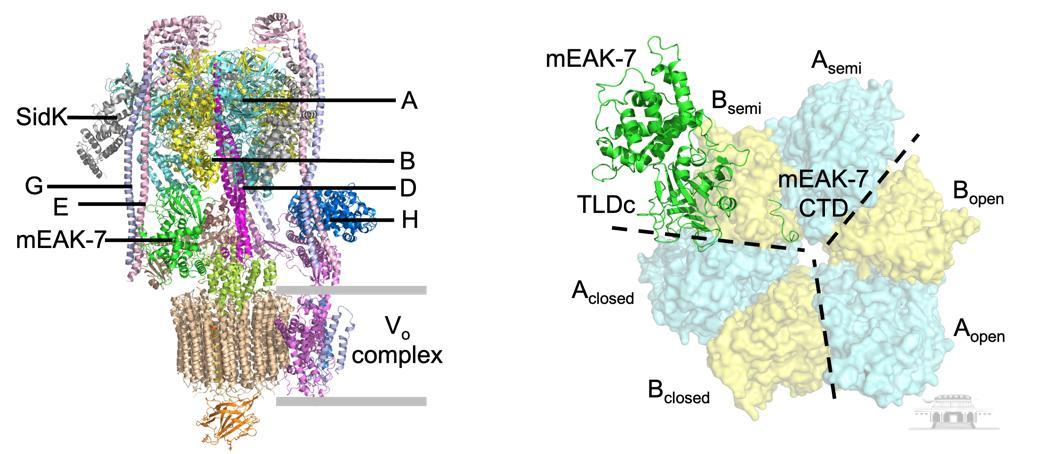
mEAK-7与V-ATPase的结构及相互作用
王隆飞课题组长期从事结构药理学研究,主要集中在天然免疫与炎症的重要靶点以及病原微生物与宿主互作,其成果先后发表在Science、MolecularCell、PNAS等杂志上,为相关疾病的治疗提出了新的理论依据。
论文链接:https://doi.org/10.1073/pnas.2203742119