近日,《自然·通讯》(Nature Communications)在线发表了588888纽约国际官方网站、中南医院药学研究院邓子新院士团队孙宇辉教授课题组关于聚酮合酶(Polyketide Synthase)系列研究的最新进展,该研究解析了模块化聚酮合酶装配线的进化过程,揭示了模块间独特的相互作用与装配线非经典作用机制的相关性,并实现了装配线的理性设计和定向改造。
阿扎霉素F(AzalomycinF)是一类36元大环内酯聚酮天然产物,具有优良的抗真菌、抗肿瘤活性。负责其生物合成的聚酮合酶装配线由8个聚酮合酶基因共编码19个模块组装而成(图1)。孙宇辉课题组在前期的探索中,运用微生物分子遗传学及生物化学研究手段,发现在一个可重复使用的模块中暗藏一个可自动开关的烯醇还原酶结构域(Enoylreductase, ER1/2),即同一个烯醇还原酶结构域在模块两次重复使用过程中,可根据需要,如电源开关般进行“关闭”或“开启”,从而催化形成相应不同的结构(Angew. Chem. Int. Ed.2017, 56: 5503-5506)。该课题组还进一步揭示该结构域可以反式作用方式,催化相邻模块上聚酮链中间体双键的还原(Angew. Chem. Int. Ed.2020, 59: 22738-22742)。这一新颖而独特的跨模块“借用”方式有别于对经典的聚酮合酶线性装配的传统认知,对其独特催化机制的认识,将有助于进一步丰富人们对聚酮合酶装配线的理解,并为聚酮合酶的理性设计提供精准指导。
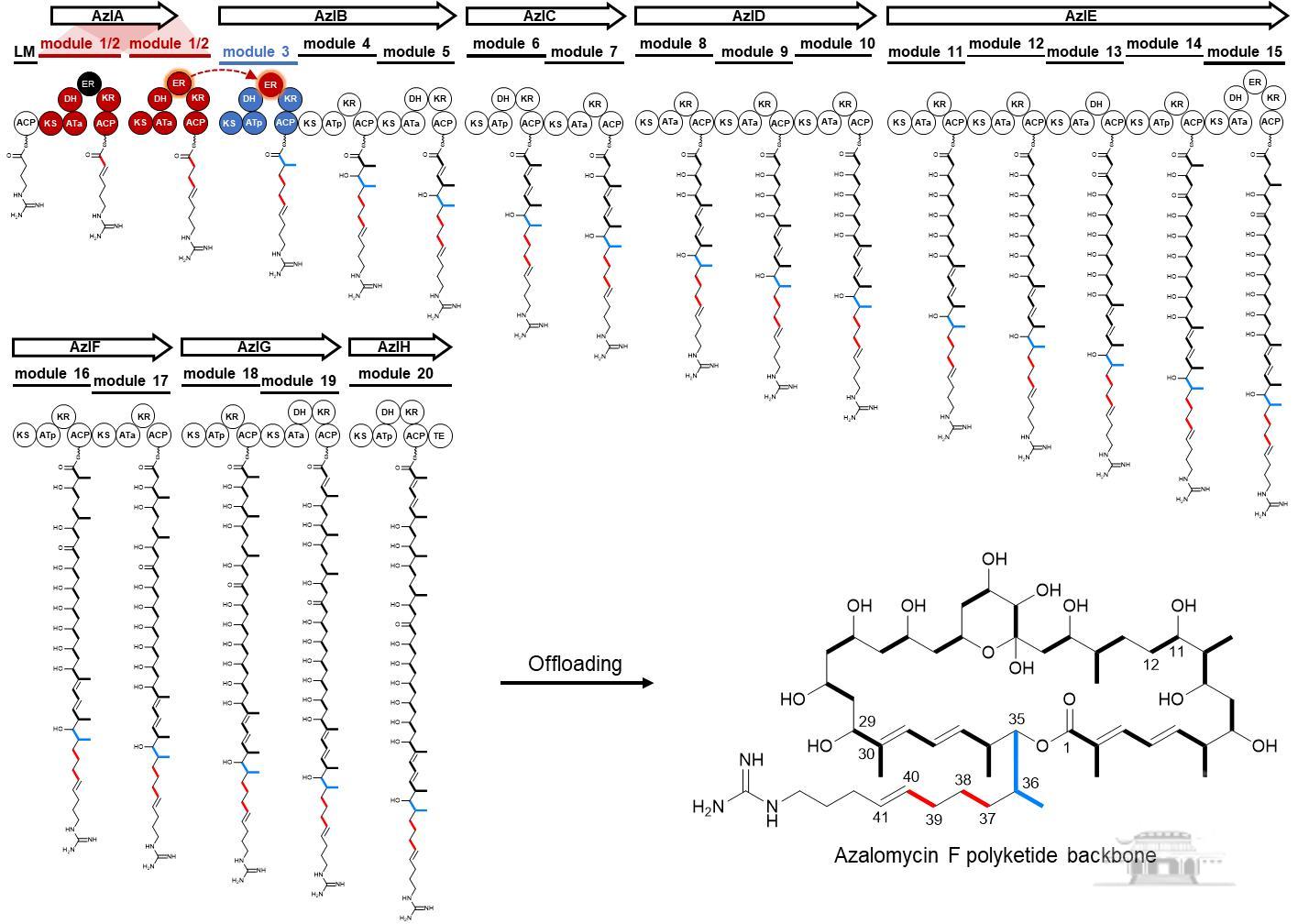
图1阿扎霉素F聚酮合酶装配线及其具有“开关”和“借用”特性的
烯醇还原酶结构域
为此,孙宇辉课题组对阿扎霉素F聚酮合酶装配线开展了更为深入的探究。首先,通过阿扎霉素F与经典和具有相似催化特征的ER结构域的体内置换,明确了ER1/2结构域与Module 3的相互作用是其独特催化现象的主要原因之一。同时,生物信息学分析显示,尽管阿扎霉素F聚酮合酶装配线中各模块均具有较高的同源性,但Module 3和Module 6的同源性显著高于该装配线其它模块,这一现象似乎有意为其进化过程留下蛛丝马迹,进而启发他们通过追踪聚酮合酶装配线进化过程,去找寻揭示该非线性催化现象背后深层次机制的关键线索。考虑到高同源性模块间的同源重组是模块化聚酮合酶装配线进化的驱动力之一,为了探究装配线可能的进化过程,验证以进化为导向进行聚酮合酶装配线工程改造的可行性,基于Module 3和Module 6高度同源性,设计并成功构建出全新结构的“精简版”阿扎霉素,该结果充分证明了模拟模块间的同源重组是一种真实可行的聚酮合酶装配线改造策略。
为了解析高度同源Module 3和Module 6进化的差异性,进一步阐明ER1/2结构域跨模块催化Module 3聚酮链中间体双键还原的工作机制,并追踪模块化聚酮合酶装配线的进化过程,课题组全面开展了一系列的结构域体内置换。结果充分表明ER1/2与KS3结构域具有特定的相互作用,这一相互作用是ER1/2结构域具有跨模块催化的内在原因之一(图2)。除此之外,该结果也充分表明Module 3及Module 6的趋异性进化发生在KS结构域,同时,暗示了基因的同质化、同源模块的重组及趋异性进化是模块化聚酮合酶可能的进化过程,这为深入理解模块化聚酮合酶装配线及进化过程提供了新的见解与灵感,也从进化视角为模块化聚酮合酶装配线的理性设计提供了理论基础。
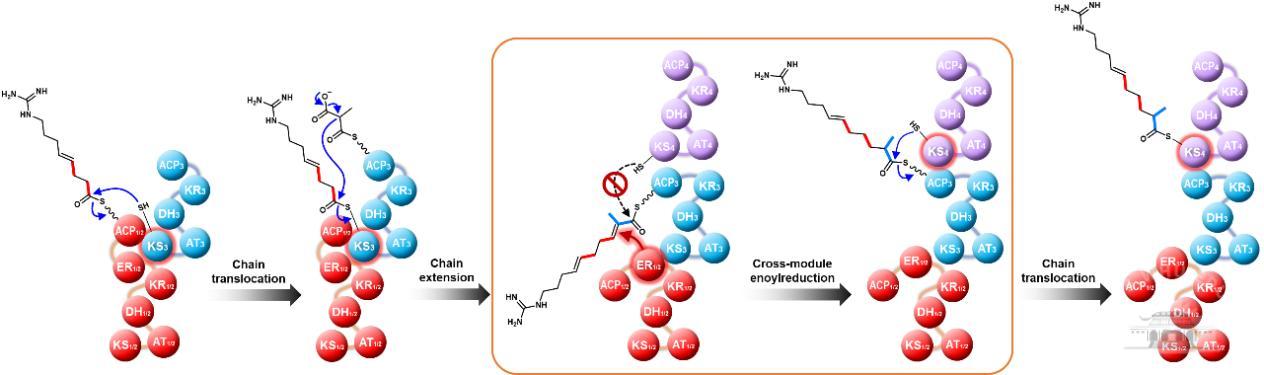
图2阿扎霉素F聚酮合酶跨模块双键还原模型
孙宇辉为该论文通讯作者,博士生翟贵发和硕士生朱妍为该论文共同第一作者,588888纽约国际官方网站为该论文第一署名单位。该研究得到了国家重点研发计划和国家自然科学面上基金的支持。
论文链接:https://www.nature.com/articles/s41467-023-36213-9