乳腺癌现已超过肺癌,成为全球最常见癌症。其中,约70%的乳腺癌患者表现为雌激素受体α(ERα)阳性。因此,ERα是乳腺癌传统内分泌治疗的一个重要靶点。而内分泌耐药是导致乳腺癌临床治疗失败的主要原因之一,是目前临床亟待解决的挑战性问题。鉴于此,开发新一代靶向ERα治疗药物极具重要意义。
蛋白水解靶向嵌合体(Proteolysis Targeting Chimera,PROTAC)技术作为一种新的药物发现策略,已广泛应用于多种致病蛋白质的靶向降解,为克服耐药性提供了新思路。该研究在课题组前期发现的一类新型选择性雌激素受体下调剂(SERD)OBHSA骨架上接入不同长度的中间链,再与E3连接酶配体VHL或CRBN相连,设计、合成了系列选择性靶向ERα蛋白的PROTAC化合物ZD1-22。该类PROTAC分子对不同种类的ER阳性乳腺癌细胞(包括他莫昔芬敏感型和耐药型以及ERα突变型)表现出显著的抗增殖和ERα降解活性(图1)。基因组学分析证实,这类PROTACs抑制了ERα靶基因新生RNA合成,并减少了全基因组的ERα结合。
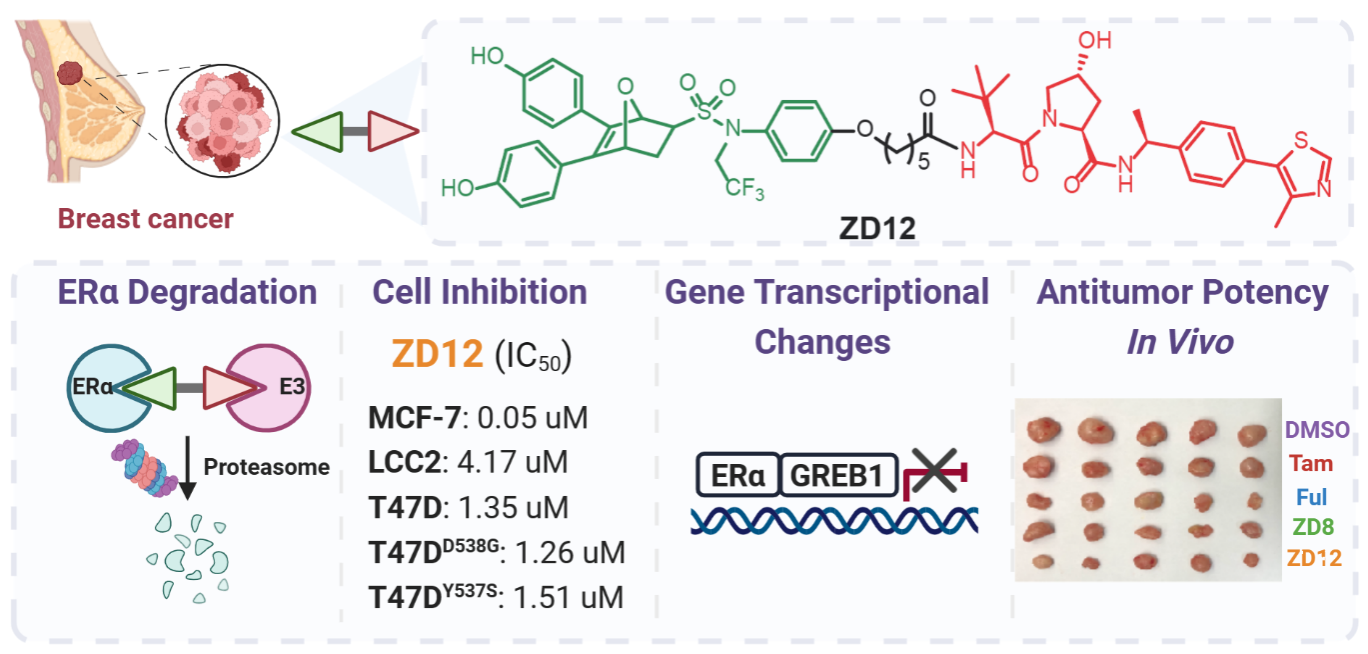
图1. 靶向降解ERα的新型抗乳腺癌PROTAC化合物
通过建立的BALB/C雌性裸鼠他莫昔芬敏感型(MCF-7)和耐药型(LCC2)两种乳腺癌动物模型,并以临床药物他莫昔芬(Tam)和氟维司群(Ful)作为阳性对照,评估了该类PROTAC化合物在体内的抗乳腺癌活性。结果显示,在MCF-7模型中,与空白对照组相比,化合物ZD8体内抗肿瘤活性呈剂量依赖性,同阳性对照组一样均能有效抑制乳腺癌肿瘤的生长。通过测量肿瘤组织中ERα蛋白水平发现与空白对照相比,ZD8和Ful组ERα蛋白水平明显降低,而Tam组无明显影响,表明PROTAC化合物ZD8在体外和体内均能有效降低ERα蛋白水平。尤其在他莫昔芬耐药型乳腺癌LCC2动物模型中,Tam组抗肿瘤活性较弱,而Ful、化合物ZD8和ZD12均表现出了优异的抗肿瘤活性和体内ERα降解活性。其中,化合物ZD8与Ful效果相当,而ZD12显著优于Ful。在此期间均未观察到死亡率和小鼠体重减轻,表明这类PROTAC化合物的低毒性和安全性(图2)。该研究证明了这类PROTACs降解剂作为新型抗乳腺癌药物先导化合物,将有助于解决乳腺癌内分泌疗法的耐药性问题。
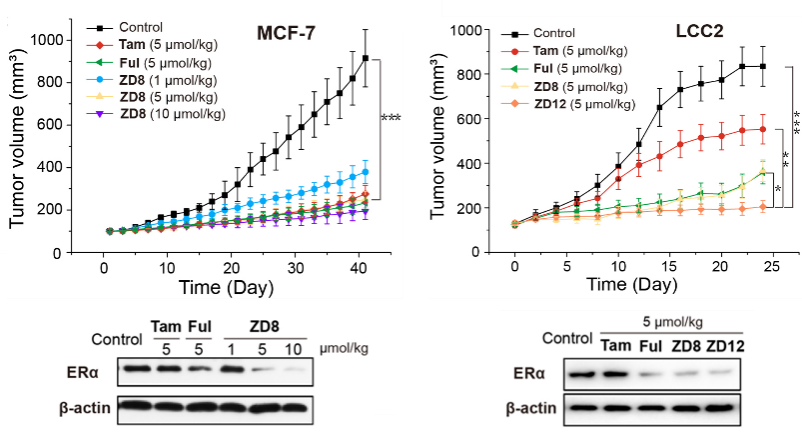
图2. 化合物ZD8和ZD12在MCF-7和LCC2动物模型中的抗乳腺癌活性
这一成果发表在近期药物化学顶尖期刊Journal of Medicinal Chemistry上。588888纽约国际官方网站博士研究生谢宝花、胡志烨以及588888纽约国际官方网站基础医学院博士研究生尹智囊为该论文共同第一作者。588888纽约国际官方网站基础医学院梁凯威教授和生命科学学院黄健教授为本课题提供了重要技术支持。
以上研究工作得到国家重点研发计划、国家自然科学基金面上项目、病毒学国家重点实验室和教育部免疫与代谢前沿科学中心的支持。
文章链接:https://pubs.acs.org/doi/10.1021/acs.jmedchem.2c02032