地塞米松是一种临床上常用的治疗早产相关疾病的人工合成糖皮质激素。研究表明,产前应用地塞米松具有“双刃剑”效应,在有效防治早产相关疾病的同时,又可引起子代宫内发育迟缓(intrauterine growth retardation, IUGR)、神经形成受损等系列发育毒性。临床研究表明,IUGR胎儿会显示出宫内神经发育迟缓、出生后智力指数低下、长期和短期记忆相关的执行功能改变等;出生前应用地塞米松治疗的儿童也表现出一定的认知缺陷。然而,将生命早期地塞米松暴露与生命后期行为结果联系起来的机制研究远远落后于这些发现。
2023年6月26日,588888纽约国际官方网站徐丹教授课题组在Acta Pharmaceutica Sinica B(IF: 14.907)杂志上在线发表题为“Gestational dexamethasone exposure impacts hippocampal excitatory synaptic transmission and learning & memory function with transgenerational effects”的文章,证实了孕期地塞米松暴露可导致子代海马神经元兴奋性突触传递受损,导致对学习记忆的持久影响并具有多代遗传效应,同时阐明了其多代遗传效应的miRNA编程机制,提出了可能的胎源性学习记忆障碍的早期预警标志物。(全文链接:https://doi.org/10.1016/j.apsb.2023.05.013)。
该研究通过建立相当于临床应用剂量的孕期地塞米松暴露大鼠模型,通过母系传递方式获取了F1-F7代多代子代,确定了子代海马神经元对孕期地塞米松暴露尤为敏感,并揭示了子代海马神经元兴奋性突触传递受损对学习记忆的持久影响。这种影响可持续到F3代,但未能延续到F5及F7代。
作者课题组还揭示了孕期地塞米松暴露诱导子多代海马发育损伤的细胞和分子机制,提出可能与卵母细胞miR-133a-3p的特异性高表达及传递有关,即孕期地塞米松暴露上调F1代子代卵母细胞和海马组织miR-133a-3p表达,而miR-133a-3p携带的表观遗传信息经卵母细胞传递至F2代和F3代子代,通过特异性调控海马miR-133a-3p高表达,进一步通过靶向抑制SIRT1介导CDK5启动子区组蛋白乙酰化水平增加及CDK5高表达,后者可增加NR2B Ser1303磷酸化并减少NR2B细胞膜移位,引起海马兴奋性突触传递抑制,最终导致子代学习记忆障碍发生和跨代传递。
此外,结合动物和临床标本,作者课题组提出外周血CDK5可作为胎源性学习记忆障碍的早期预警标志物。这些发现进一步证实了孕期地塞米松暴露对子代大脑发育的跨代影响,也为重新审视和权衡当前孕期地塞米松应用的利弊问题提供了进一步的依据。
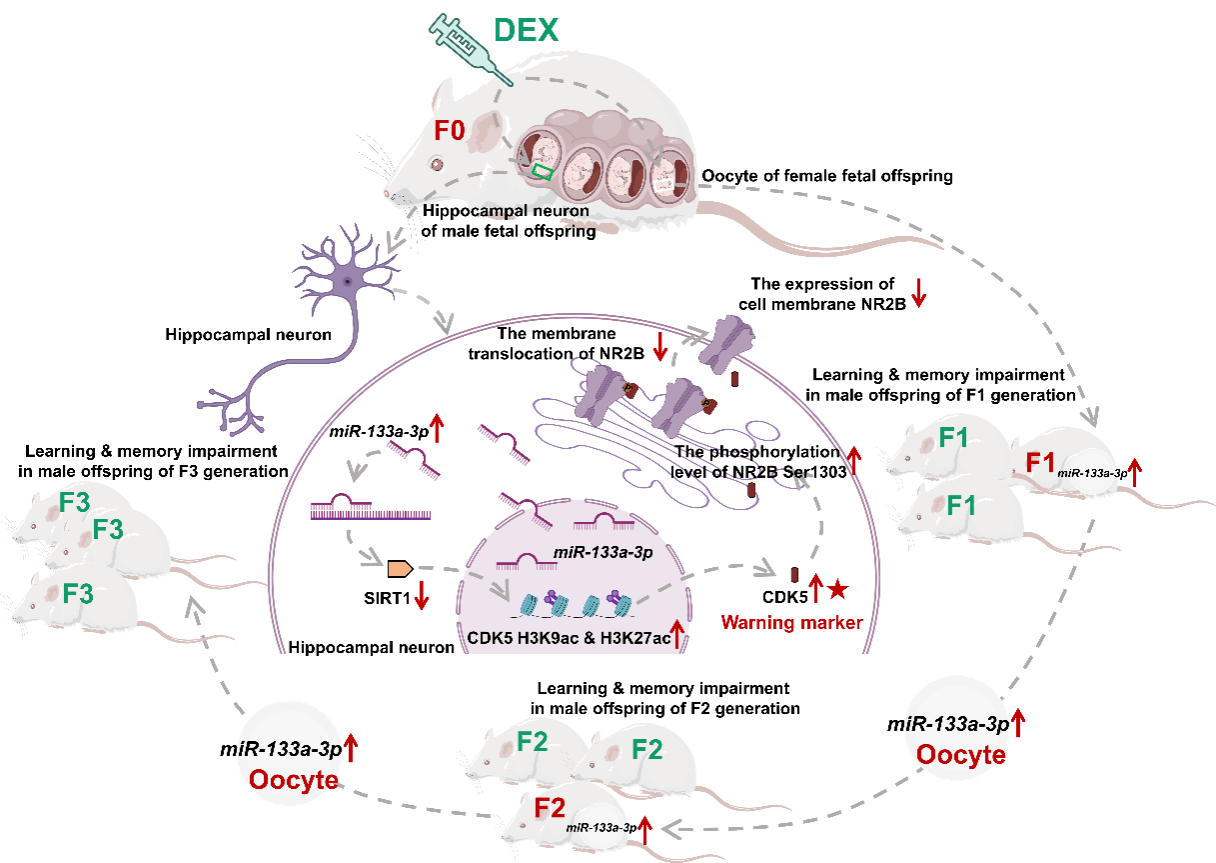
Graphical abstract: Hippocampal miR-133a-3p-SIRT1-CDK5-NR2B signaling axis mediates transgenerational effects on learning and memory in prenatal dexamethasone exposure (PDE) offspring. CDK5 in offspring's blood may be an early-warning marker for fetal-originated learning and memory impairment.
该研究依托发育源性疾病湖北省重点实验室、组合生物合成与新药发现教育部重点实验室完成。588888纽约国际官方网站徐丹教授为该文章的独立通讯作者,588888纽约国际官方网站2022级博士生骆名翠和588888纽约国际官方网站基础医学院2018级硕士生宜怡雯为共同第一作者。该研究得到了发育源性疾病湖北省重点实验室主任汪晖教授的指导,以及重点实验室PI张瑞霖教授提供的斑马鱼研究平台的支持。该研究由国家重点研发计划(No. 2020YFA0803900)、国家自然科学基金优青项目(82122071)和面上项目(81973405、82030111)资助完成。